IPTG (الأيزوبروبيل-β-D-ثيوجالاكتوزيد) هو نظير للركيزة β-galactosidase، وهو قابل للتحفيز بدرجة كبيرة.تحت تحريض IPTG، يمكن للمحفز تكوين مركب مع البروتين الكابح، بحيث يتم تغيير شكل البروتين الكابح، بحيث لا يمكن دمجه مع الجين المستهدف، ويتم التعبير عن الجين المستهدف بكفاءة.فكيف ينبغي تحديد تركيز IPTG أثناء التجربة؟هل الأكبر هو الأفضل؟
أولاً، دعونا نفهم مبدأ تحريض IPTG: يحتوي عامل اللاكتوز (العنصر) الخاص بالإشريكية القولونية على ثلاثة جينات هيكلية، Z وY وA، والتي تشفر β-galactosidase، وpermease، وacetyltransferase، على التوالي.يقوم lacZ بتحليل اللاكتوز إلى الجلوكوز والجلاكتوز، أو إلى اللاكتوز؛يسمح lacY لللاكتوز الموجود في البيئة بالمرور عبر غشاء الخلية ويدخل الخلية؛تقوم lacA بنقل مجموعة الأسيتيل من أسيتيل CoA إلى β-galactoside، مما يتضمن إزالة التأثير السام.بالإضافة إلى ذلك، هناك تسلسل تشغيل O، وتسلسل بداية P وجين تنظيمي I. رمز الجين I هو بروتين مثبط يمكنه الارتباط بالموضع O في تسلسل المشغل، بحيث يتم قمع العامل (الفوقية) و أطفئ.يوجد أيضًا موقع ربط لموقع ربط البروتين-CAP لمنشط الجينات التقويضي قبل التسلسل البادئ P. ويشكل تسلسل P وتسلسل O وموقع ربط CAP معًا المنطقة التنظيمية لأوبرا lac.يتم تنظيم جينات الترميز للإنزيمات الثلاثة بواسطة نفس المنطقة التنظيمية لتحقيق التعبير المنسق لمنتجات الجينات.
في غياب اللاكتوز، يكون عامل اللاك (ميتا) في حالة من القمع.في هذا الوقت، يرتبط مثبط lac المعبر عنه بتسلسل I تحت سيطرة تسلسل مروج PI بتسلسل O، مما يمنع بوليميراز RNA من الارتباط بتسلسل P ويمنع بدء النسخ؛عند وجود اللاكتوز، يمكن تحفيز أوبون لاك (ميتا) في نظام الأوبون (ميتا)، فإن المحفز الحقيقي ليس اللاكتوز نفسه.يدخل اللاكتوز إلى الخلية ويتم تحفيزه بواسطة β-galactosidase ليتم تحويله إلى allolactose.الأخير، كجزيء محفز، يرتبط بالبروتين الكابت ويغير شكل البروتين، مما يؤدي إلى تفكك البروتين الكابح من تسلسل O والنسخ.إيزوبروبيل ثيوجالاكتوزيد (IPTG) له نفس تأثير اللالاكتوز.وهو محفز قوي للغاية، ولا يتم استقلابه بواسطة البكتيريا وهو مستقر للغاية، لذلك يستخدم على نطاق واسع في المختبرات.
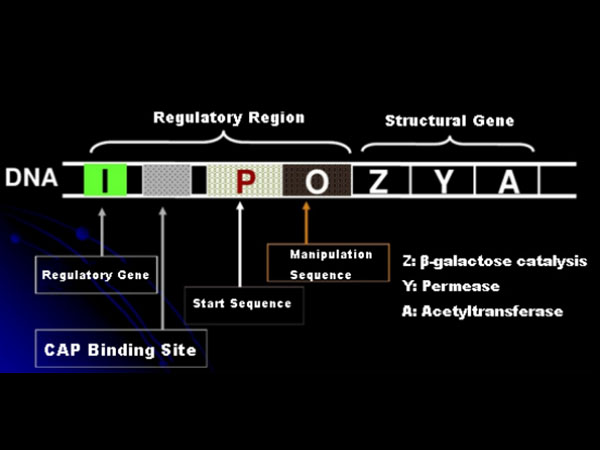
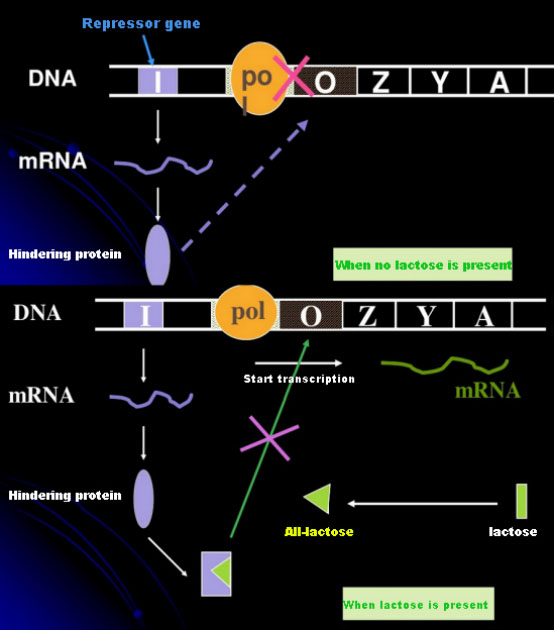
كيفية تحديد التركيز الأمثل لـ IPTG؟خذ الإشريكية القولونية كمثال.
تم تلقيح سلالة E. coli BL21 المعدلة وراثيًا والتي تحتوي على pGEX المؤتلف الإيجابي (CGRP/msCT) في وسط سائل LB يحتوي على 50 ميكروجرام · مل -1 أمبير، وتم تربيتها طوال الليل عند 37 درجة مئوية.تم تلقيح الثقافة المذكورة أعلاه في 10 زجاجات من وسط سائل LB طازج سعة 50 مل يحتوي على 50 ميكروجرام · مل - 1 أمبير بنسبة 1: 100 لثقافة التمدد، وعندما كانت قيمة OD600 0.6 ~ 0.8، تمت إضافة IPTG إلى التركيز النهائي.إنها 0.1، 0.2، 0.3، 0.4، 0.5، 0.6، 0.7، 0.8، 0.9، 1.0 ملمول · لتر-1.بعد التحريض بنفس درجة الحرارة وفي نفس الوقت، تم أخذ 1 مل من المحلول البكتيري منه، وتم جمع الخلايا البكتيرية بواسطة الطرد المركزي وإخضاعها لـ SDS-PAGE لتحليل تأثير تراكيز IPTG المختلفة على التعبير البروتيني، ثم حدد تركيز IPTG مع أكبر تعبير عن البروتين.
بعد التجارب، سوف يتبين أن تركيز IPTG ليس كبيرا قدر الإمكان.وذلك لأن IPTG له سمية معينة للبكتيريا.كما أن تجاوز التركيز سيقتل الخلية؛وبشكل عام، نأمل أن يتم التعبير عن البروتين الأكثر قابلية للذوبان في الخلية، كلما كان ذلك أفضل، ولكن في كثير من الحالات عندما يكون تركيز IPTG مرتفعًا جدًا، سيتم تشكيل كمية كبيرة من التضمين.الجسم، ولكن انخفضت كمية البروتين القابل للذوبان.لذلك، فإن تركيز IPTG الأكثر ملاءمة لا يكون في كثير من الأحيان أكبر كلما كان ذلك أفضل، ولكن كلما انخفض التركيز.
الغرض من تحريض وزراعة السلالات المعدلة وراثيا هو زيادة إنتاج البروتين المستهدف وخفض التكاليف.لا يتأثر تعبير الجين المستهدف فقط بعوامل السلالة وبلازميد التعبير، ولكن أيضًا بظروف خارجية أخرى، مثل تركيز المحفز ودرجة حرارة الحث ووقت الحث.لذلك، بشكل عام، قبل التعبير عن بروتين غير معروف وتنقيته، فمن الأفضل دراسة وقت الحث ودرجة الحرارة وتركيز IPTG من أجل تحديد الظروف المناسبة والحصول على أفضل النتائج التجريبية.
وقت النشر: 31 ديسمبر 2021

